กรด (Acid) และเบส (Base) เป็นสารเคมีสองประเภทที่สำคัญที่สุดในวิทยาศาสตร์ ไม่ว่าคุณจะกำลังจิบน้ำมะนาว กินยาลดกรดสำหรับอาการเสียดท้อง หรือผสมสารเคมีในห้องแล็บ เคมีกรด-เบสก็มีบทบาทเช่นกัน แต่กรดและเบสคืออะไรกันแน่ ทำไมจึงมีความสำคัญ และทำงานอย่างไร
ในบทความนี้ เราจะเจาะลึกเข้าไปในโลกของเคมีกรด-เบส สารเหล่านี้คืออะไร มีพฤติกรรมอย่างไร เราวัดความเข้มข้นของสารเหล่านี้อย่างไร และเราเห็นสารเหล่านี้ในชีวิตประจำวันได้อย่างไร ไม่ว่าคุณจะเป็นนักเรียนที่กำลังทบทวนบทเรียนเพื่อสอบหรือเพียงแค่สงสัยเกี่ยวกับวิทยาศาสตร์เบื้องหลังผลิตภัณฑ์ในครัวเรือน คุณมาถูกที่แล้ว
กรดคืออะไร?
กรดคือสารที่สามารถบริจาคโปรตอน (ไอออน H⁺) ให้กับสารอื่นได้ พูดง่ายๆ ก็คือ กรดจะปล่อยไอออนไฮโดรเจนเมื่อละลายในน้ำ ไอออนไฮโดรเจนเหล่านี้ทำให้กรดมีรสเปรี้ยวตามลักษณะเฉพาะและมีปฏิกิริยาตอบสนอง

คุณสมบัติทั่วไปของกรด:
- รสเปรี้ยว (เช่น น้ำมะนาวหรือน้ำส้มสายชู)
- กัดกร่อน (กรดเข้มข้นสามารถทำลายวัสดุและผิวหนังได้)
- ทำให้กระดาษลิตมัสสีน้ำเงินเปลี่ยนเป็นสีแดง
- ค่า pH ต่ำกว่า 7
- ทำปฏิกิริยากับโลหะเพื่อผลิตก๊าซไฮโดรเจน
ตัวอย่างของกรด:
- กรดไฮโดรคลอริก (HCl) พบในกรดในกระเพาะอาหาร
- กรดซัลฟิวริก (H₂SO₄) ใช้ในแบตเตอรี่รถยนต์
- กรดซิตริก พบในผลไม้ที่มีรสเปรี้ยว
- กรดอะซิติก ส่วนประกอบหลักของน้ำส้มสายชู
ด่าง เบส (Base) คืออะไร?
เบส (Base) คือสารที่สามารถรับโปรตอนได้ หรือในหลายๆ กรณีสามารถปลดปล่อยไอออนไฮดรอกไซด์ (OH⁻) ในสารละลายได้ เบสมีรสขมและสัมผัสลื่นเหมือนสบู่

คุณสมบัติทั่วไปของเบส:
- รสขม
- เนื้อสัมผัสลื่น
- ทำให้กระดาษลิตมัสเปลี่ยนเป็นสีแดงเป็นสีน้ำเงิน
- ค่า pH สูงกว่า 7
- สามารถทำให้กรดเป็นกลางได้
ตัวอย่างของเบส:
- โซเดียมไฮดรอกไซด์ (NaOH) ใช้ในน้ำยาทำความสะอาดท่อ
- แอมโมเนีย (NH₃) มักพบในผลิตภัณฑ์ทำความสะอาด
- แคลเซียมไฮดรอกไซด์ (Ca(OH)₂) ใช้ในซีเมนต์และปูนปลาสเตอร์
- แมกนีเซียมไฮดรอกไซด์ พบในนมแมกนีเซีย (ยาลดกรด)
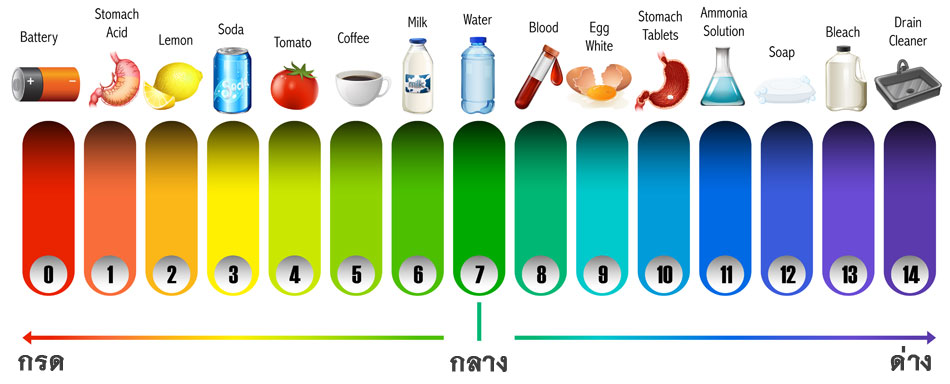
มาตราวัดค่า pH: การวัดความเป็นกรดและด่าง
มาตราวัดค่า pH จะวัดความเป็นกรดหรือด่างของสารละลาย โดยมีค่าตั้งแต่ 0 ถึง 14:
- pH < 7: เป็นกรด
- pH = 7: เป็นกลาง (น้ำบริสุทธิ์)
- pH > 7: เบส (หรือด่าง)
แต่ละขั้นของมาตราวัดจะแสดงถึงการเปลี่ยนแปลงความเข้มข้นของไอออนไฮโดรเจนเป็นสิบเท่า ตัวอย่างเช่น สารละลายที่มีค่า pH 3 จะมีความเป็นกรดมากกว่าสารละลายที่มีค่า pH 4 ถึง 10 เท่า
ทฤษฎีต่างๆ ของกรดและเบส
นักวิทยาศาสตร์ได้พัฒนารูปแบบต่างๆ เพื่ออธิบายพฤติกรรมของกรด-เบสมาโดยตลอด ทฤษฎีหลัก 3 ประการมีดังนี้:
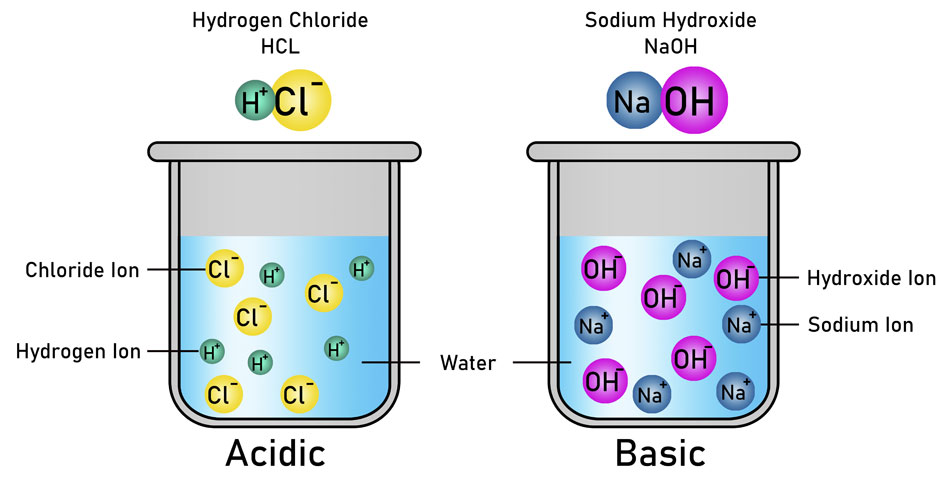
1. คำจำกัดความของอาร์เรเนียส (Arrhenius ในปี ค.ศ.1884)
- กรด: ผลิตไอออน H⁺ ในน้ำ
- เบส: ผลิตไอออน OH⁻ ในน้ำ
- ข้อจำกัด: ใช้ได้เฉพาะในสารละลายในน้ำเท่านั้น
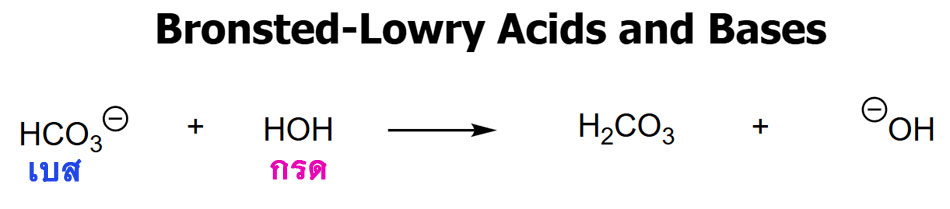
2. คำจำกัดความของบรอนสเตด-โลว์รี (Brønsted-Lowry ในปี ค.ศ. 1923)
- กรด: ตัวให้โปรตอน
- เบส: ตัวรับโปรตอน
- ทั่วไปกว่าและใช้ได้ในสภาพแวดล้อมที่ไม่ใช่น้ำ
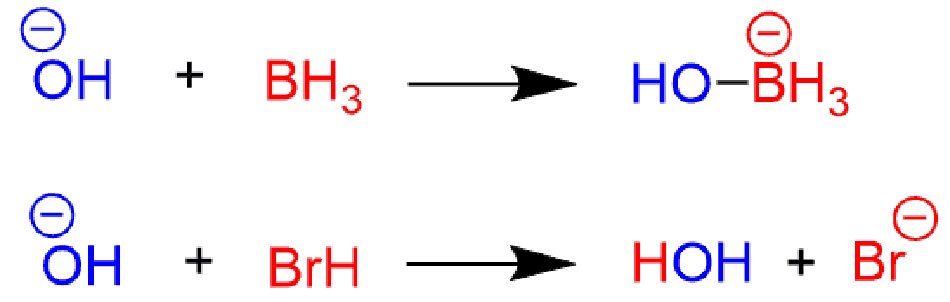
3. คำจำกัดความของลูอิส (Lewis ในปี ค.ศ. 1923)
- กรด: ตัวรับคู่อิเล็กตรอน
- เบส: ตัวให้คู่อิเล็กตรอน
- กว้างที่สุดและใช้ในเคมีขั้นสูง
กรดและเบสในชีวิตประจำวัน
คุณพบกรดและเบสบ่อยกว่าที่คุณคิด:
- ในครัว: น้ำมะนาว น้ำส้มสายชู โยเกิร์ต (กรด) เบกกิ้งโซดา ไข่ สบู่ (เบส)
- ในยา: ยาลดกรด (เบสช่วยทำให้กรดในกระเพาะเป็นกลาง) แอสไพริน (กรด)
- ในการทำความสะอาด: น้ำยาทำความสะอาดห้องน้ำ (มักเป็นกรด)
- น้ำยาฟอกขาวและแอมโมเนีย (เบส)
- ในอุตสาหกรรม: ปุ๋ย สีย้อม
การทำความเข้าใจว่ากรดและเบสมีปฏิกิริยากันอย่างไรช่วยได้ทุกอย่างตั้งแต่การทำอาหาร การทำความสะอาด ไปจนถึงการผลิต











